La conférence annuelle américaine, la CROI (pour conference on retrovirus and opportunistic infections) édition 2022 s’est bien tenue du 13 au 16 février. Mais contrairement aux espoirs de l’an passé, elle n’a pas eu lieu à Denver, Colorado mais en version distancielle exclusivement comme la précédente, et ce, pour la même raison, la situation sanitaire de l’épidémie de COVID-19.

Comme l’année précédente, le programme de cette CROI 2022 est structuré de la même manière que tous les ans mais adapté au format particulier qui tient compte de la dispersion des participants tant géographiquement que sur le plan temporel. C’est aussi pour cette raison que le programme de symposiums qui habituellement conclue chaque journée a été déplacé sur trois jours supplémentaires, du 22 au 24 février.
C’est donc sur le canapé du salon que nous avons découvert cette CROI 2022. Une conférence qui respecte la tradition de rencontre de recherche scientifique de haut niveau, mais qui a été cette année très influencé par le contexte sanitaire puisque le Sars-Cov-2 et le COVID-19 se sont invités dans de très nombreuses présentations et sessions.

La CROI 2022 a été bien suivie cette année, peut-être même plus que la version virtuelle de l’an passé. Cela est peut-être dû au fait que jusqu’au 18 janvier les inscriptions étaient en cours comme si de rien était avant que l’organisateur annonce que, finalement la conférence se tiendrait uniquement dans l’espace virtuel. A moins que ce ne soit précisément l’effet de l’annonce dès le départ que la conférence serait accessible aussi bien sur place qu’à distance qui a provoqué un engouement plus important. Comment savoir…

Ce qui est aussi remarquable dans cette édition c’est l’importance considérable de la recherche fondamentale qui a pris largement le pas sur la recherche clinique et n’a laissé que peu de place à la recherche en prévention et à l’épidémiologie.
Ce que nous vous proposons dans cette rétrospective, c’est donc d’une part de découvrir les fondements de ce qui aura beaucoup occupé l’actualité de ces temps de COVID-19, la recherche vaccinale, l’utilisation des ARN messagers et le lien de tout ça avec la recherche sur le VIH.
Dans un autre article nous essaierons de présenter divers aspects de la recherche clinique et en prévention présentés à cette conférence.
Voici donc le résumé de trois présentations majeures de cette conférence qui permettent de mieux comprendre où en est la recherche vaccinale VIH.

Stratégies vaccinales pour le VIH et le COVID-19
Le VIH et le SARS-CoV-2 sont la cause de deux pandémies mondiales très différentes. Le VIH cause une pandémie depuis 40 ans, c’est un rétrovirus qui provoque une infection chronique persistante et une maladie, le sida due à l’immunodéficience qu’il provoque. Elle a touché 79 millions de personnes dans le monde et fait 38 millions de morts. La diversité du VIH est énorme, la protéine d’enveloppe Env est difficile à neutraliser et il n’y a pas de vaccin à ce jour.
Le SARS-CoV-2 est connu depuis 2 ans. C’est un coronavirus qui provoque une infection aiguë et une maladie respiratoire, le COVID-19. Il a infecté jusque-là 408 millions de personnes et fait 5,8 millions de morts. Le virus a une diversité limitée, sa protéine d’enveloppe, Spike est aisément neutralisable et il existe de nombreux vaccins pour le combattre.
Les défis que représentent la constitution d’un vaccin contre le VIH sont nombreux : sa diversité génétique est énorme, il s’installe durablement dans des réservoirs cellulaires latents, les corrélats de protection immunitaires ne sont pas clairement définis, il échappe facilement aux défenses immunitaires humorales et cellulaires, on n’a pas encore trouvé de méthode pour provoquer la formation d’anticorps neutralisants efficaces et l’usage de virus atténués pour un vaccin n’est pas sûre.

Au cours des recherches vaccinales sur le VIH, de nouvelles plateformes de développement de vaccin ont vu le jour, d’une part les vaccins à acide nucléique, ADN ou ARN messager, d’autre part les vaccins à vecteur viral, adénovirus et poxvirus notamment.
Les recherches vaccinales sur le VIH se sont focalisées au départ sur l’immunité humorale puis sur l’immunité cellulaire avant de proposer des solutions combinées. Pour autant, jusque là aucune de ces pistes n’a permis d’obtenir un résultat probant.
En recherche pré-clinique, les propositions de vaccin à adénovirus type Ad26/Env SIV ont montré une efficacité de 50% chez les primates mais la réponse immunitaire s’érodait avec le temps. Récemment, le vaccin Ad26 Mosaic VIH-1 a permis de nouvelles études cliniques d’efficacité (HVTN705 et HVTN706). Ces vaccins présentent une variété d’immunogènes et les essais présentent des différences méthodologiques susceptibles d’explorer des pistes variées. Mais les résultats présentés dans cette conférence montrent une efficacité jugée insuffisante pour poursuivre dans cette voie.
En 40 ans il a été évalué 5 concepts différents de vaccin. C’est sans doute insuffisant. Pour autant, les efforts de recherche se poursuivent avec des pistes nouvelles. Parallèlement, des solutions non vaccinales sont apparues dans le champ de la prévention tels que la PrEP ou l’usage d’anticorps monoclonaux neutralisants. Ainsi les essais de l’anticorps VRC01 ont montré des résultats encourageants même s’ils connaissent aussi des limites.
En décembre 2019 apparaissait une nouvelle infection causée par un coronavirus, le SARS-CoV-2. Les premiers cas ont été jugés suffisamment alarmants pour stimuler la recherche vaccinale. Face à l’impressionnant développement de la maladie, la communauté scientifique a répondu d’une manière inédite. Dès la fin 2020, de nombreux essais d’efficacité de vaccins étaient en cours et rapidement des résultats remarquables ont été produits : 95% d’efficacité (deux injections) pour Pfizer, 94% (deux injections) pour Moderna, 94% (deux injections) pour Johnson&Johnson, pour ne citer que ceux-là. Bien sûr ce sont des résultats obtenus avant l’arrivée du variant omicron.
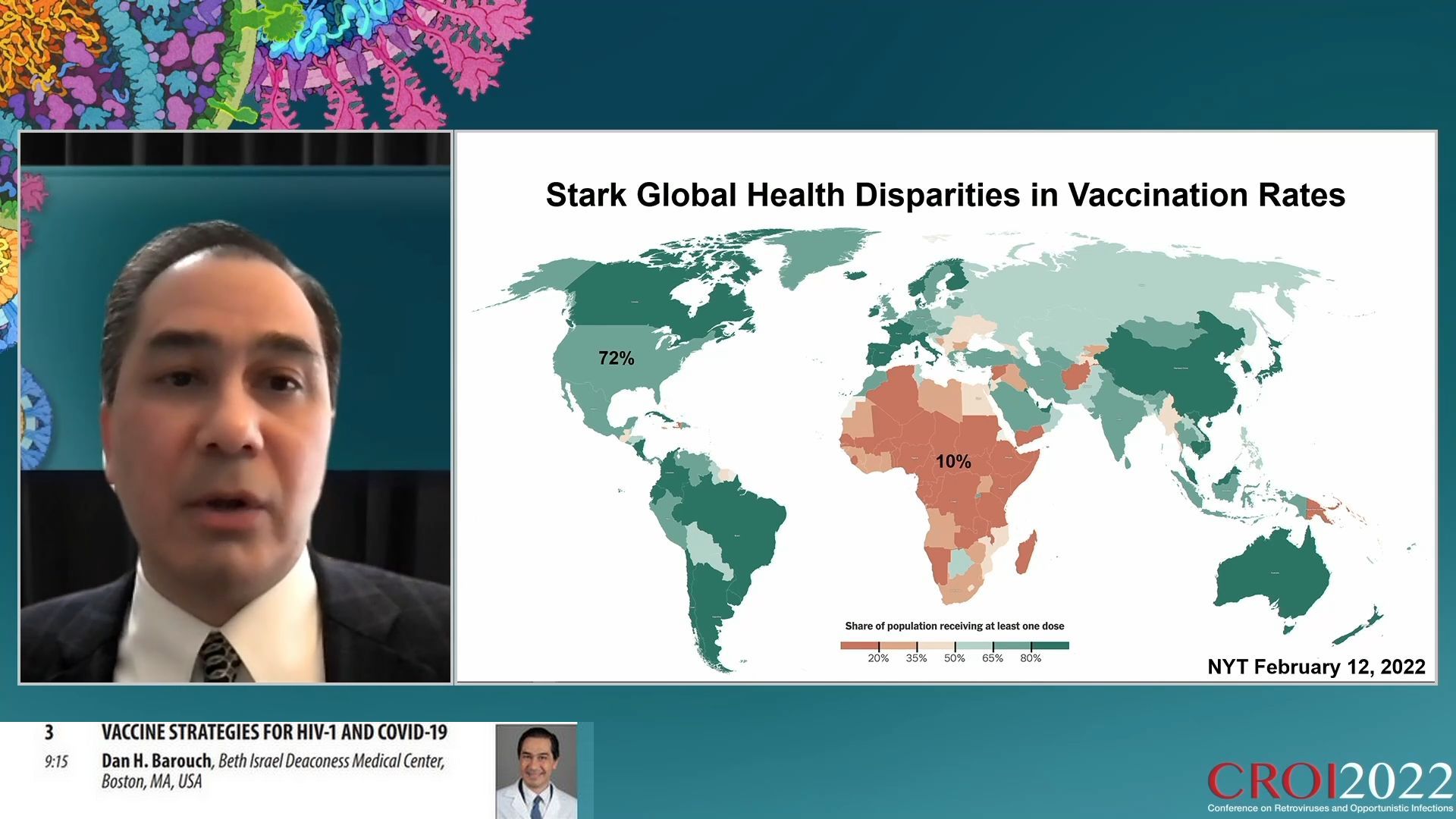
Et pourtant, on n’a pas réussi à contrôler la pandémie. Essentiellement pour les raisons suivantes : les disparités locales et mondiales de santé et d’accès à la santé, les mauvaises informations et l’hésitation face à la vaccination, le déclin de la protection conférée par les vaccins et l’émergence de variants.
A côté des vaccins ARNm de Pfizer et Moderna, il est apparu également intéressant de tester la piste adénovirus. C’est ce qui a été fait avec le Ad26.COV2.S testé dès décembre 2020 qui a permis la production du vaccin Johnson&Johnson. Il est intéressant de comparer l’immunogénicité de ces vaccins. C’est ce qui a été fait dans une étude menée à Boston. Elle montre que si les titres d’anticorps produits lors de la vaccination par ARNm sont extrêmement élevés comparé à ceux de l’AD26 plus modestes, leur déclivité avec le temps est plus rapide et rejoignent au bout de 8 mois ceux produits par l’Ad26 qui déclinent peu. Pour ce qui est de la réponse cellulaire, les trois vaccins produisent une réponse CD4 importante et sensiblement similaire. Elle ne bouge pas dans le temps. Pas plus que pour la réponse CD8 mais cette dernière est plus élevée pour le vaccin Ad26.
Mais nous sommes maintenant dans la phase omicron de la pandémie. L’analyse de ce variant laissait à penser un certain échappement aux anticorps. En fait les analyses montrent que la baisse d’efficacité n’est que partielle et qu’une dose de rappel la renforce largement. Une certaine réduction d’efficacité sur omicron est observée au bout de 6 mois mais les valeurs restent largement au-dessus des niveaux recherchés. Pour ce qui est des réponses cellulaires, elles apparaissent comme très peu affectées par le changement de variant. Même au bout de 8 mois. La principale faiblesse de ces vaccins face au variant omicron reste la protection contre la contamination. Il apparait aussi que la protection contre le développement de formes sévères est certainement associée à la persistance de l’efficacité de ces vaccins sur l’immunité cellulaire qui ne faiblit pas.
En conclusion, on peut dire que de ces recherches, il apparait que les immunités humorales (les anticorps) et cellulaires (les réponses CD4 et CD8) sont deux composantes inséparables qui fonctionnent ensemble. Après 40 ans d’intense recherche, le vaccin VIH reste un défi à remporter. De multiples vaccins contre le SARS-CoV-2 ont été produits en un temps record mais ils ne résolvent pas tout. Il faudra certainement trouver une solution plus durable que les rappels de vaccination périodiques qui posent notamment la question de l’accès à la santé.
Mais la conclusion la plus importante au vu de ces recherches est le fait que les incroyables efforts de recherche sur le vaccin VIH ont permis de telles avancées en immunologie et dans la technologie vaccinale qu’ils ont incontestablement permis le développement si rapide des vaccins contre le SARS-CoV-2.

Vaccins à ARNm pour le COVID-19, le VIH et d’autres pathogènes
Contrairement à ce que l’actualité récente tend à nous laisser penser, l’ARN messager à visée thérapeutique n’a pas été découvert il y a deux ans. Il a été injecté à un animal en tant qu’encodeur de protéines en 1990. Il a depuis été expérimenté en tant que vaccin de diverses manières mais a peu été utilisé. La raison en est que son mode d’action en tant qu’activateur de capteurs de l’immunité est extrêmement complexe. De plus à l’époque des premiers essais, on n’avait pas la connaissance de ces très nombreux capteurs et les effets d’activation de l’immunité des différents ARNm connus étaient très variables. De plus, il existe un nombre considérable d’opérations de modifications de l’ARN dans les cellules qui dépendent des messages codés par ces ARN, ce qui rend la tâche encore plus complexe. C’est à force de nombreuses études sur ces phénomènes qu’il a été possible de commencer à construire des choses cohérentes et de produire des ARN modifiés adaptés à un usage thérapeutique.
On est alors au début des années 2000. Mais l’ARN reste considéré comme quelque chose de très complexe à appréhender. D’autant plus qu’à cette époque, l’industrie pharmaceutique possède une maîtrise de la production de protéines à usage thérapeutique. Elle est cependant très délicate et nécessite une étape de purification pour éliminer les protéines mal formées susceptibles de générer des effets inattendus indésirables. De plus chaque nouveau produit nécessite la mise en œuvre de procédures de production et de purification spécifique. C’est notamment ce qui explique les prix exorbitants des anticorps monoclonaux thérapeutiques. Cela fait toute la différence avec la production d’ARNm tels que l’utilisent Moderna et Pfizer dont les produits sont réalisés à partir d’une réaction unique et purifiés par un procédé qui ne dépend pas de la séquence codée. Les protéines sont produites par les cellules de l’hôte auquel sont injectés ces ARN. Il s’agit donc d’une technique plus simple, plus sûre et bien moins onéreuse.

La question a ensuite été de savoir comment administrer ces ARN thérapeutiques. L’idée a été d’utiliser des capsules lipidiques dites nanoparticules lipidiques ou LNP (en anglais) qui sont absorbées par le foie après injection intraveineuse et permettent une biodisponibilité thérapeutique de 24 à 48 heures. Cette technique a été mise au point au départ pour des ARNsi, de petits ARN régulateurs à usage thérapeutique. Il a fallu adapter cette technique pour des ARNm et maîtriser les modes d’administration pour obtenir une effectivité du produit injecté suffisamment longue. Cela a été étudié avec des vaccins grippaux à ARNm sur des souris.
Les résultats de ces essais de vaccination grippale ont été spectaculaires avec des titres de protéines codées produites cent fois supérieurs à ce que l’on obtient en injectant un virus inactivé et 25 fois ce que produit le virus actif. Les études ont montré que les comptes de lymphocytes B spécifiques produits par l’injection d’un ARNm-LNP étaient au moins 5 fois supérieurs à ceux d’une immunisation par un virus inactivé. La puissante réponse anticorps est due à une très forte réponse des cellules T folliculaires dendritiques qui induisent au moins la moitié des réponses de lymphocytes T auxiliaires.
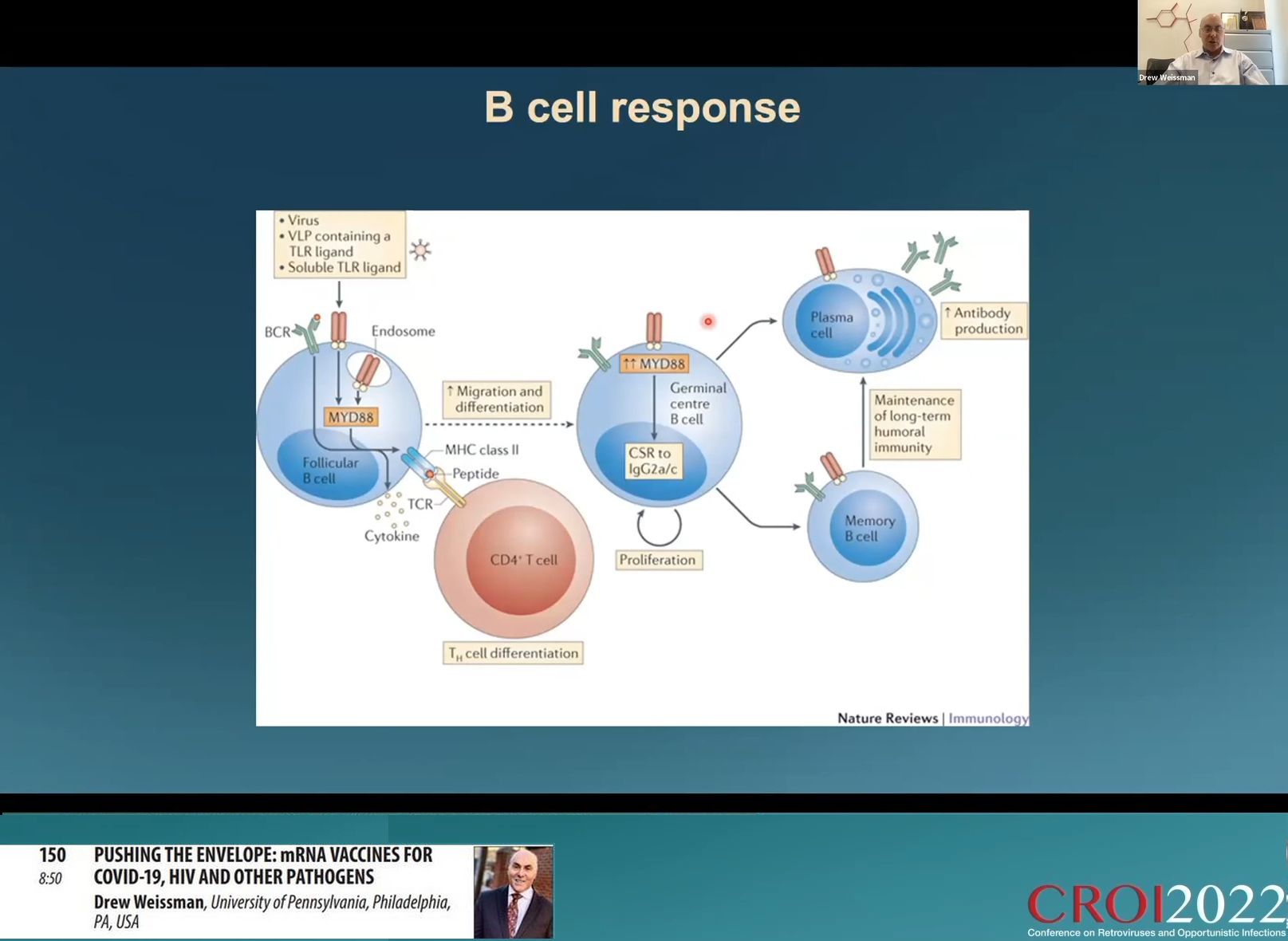
D’autres investigations sur les modes d’action de ces vaccins ont débouché sur les pistes possibles du développement d’une vaccination VIH à ARNm en plusieurs étapes utilisant la possibilité de cibler plusieurs pistes de neutralisation du virus. C’est ce qui constitue le travail actuel des recherches.

L’histoire et l’avenir de la vaccination VIH
Malgré les succès incontestables obtenus par les thérapies antirétrovirales sur l’évolution de la pandémie d’infection à VIH dans le monde, il est difficile de se résoudre à voir tous les ans le nombre de personnes séropositives au VIH augmenter d’un million et demi de nouveaux cas et de voir 850 000 personnes en mourir. La recherche d’un vaccin demeure plus que jamais d’actualité. Mais nous connaissons tous l’immense difficulté que cela représente.
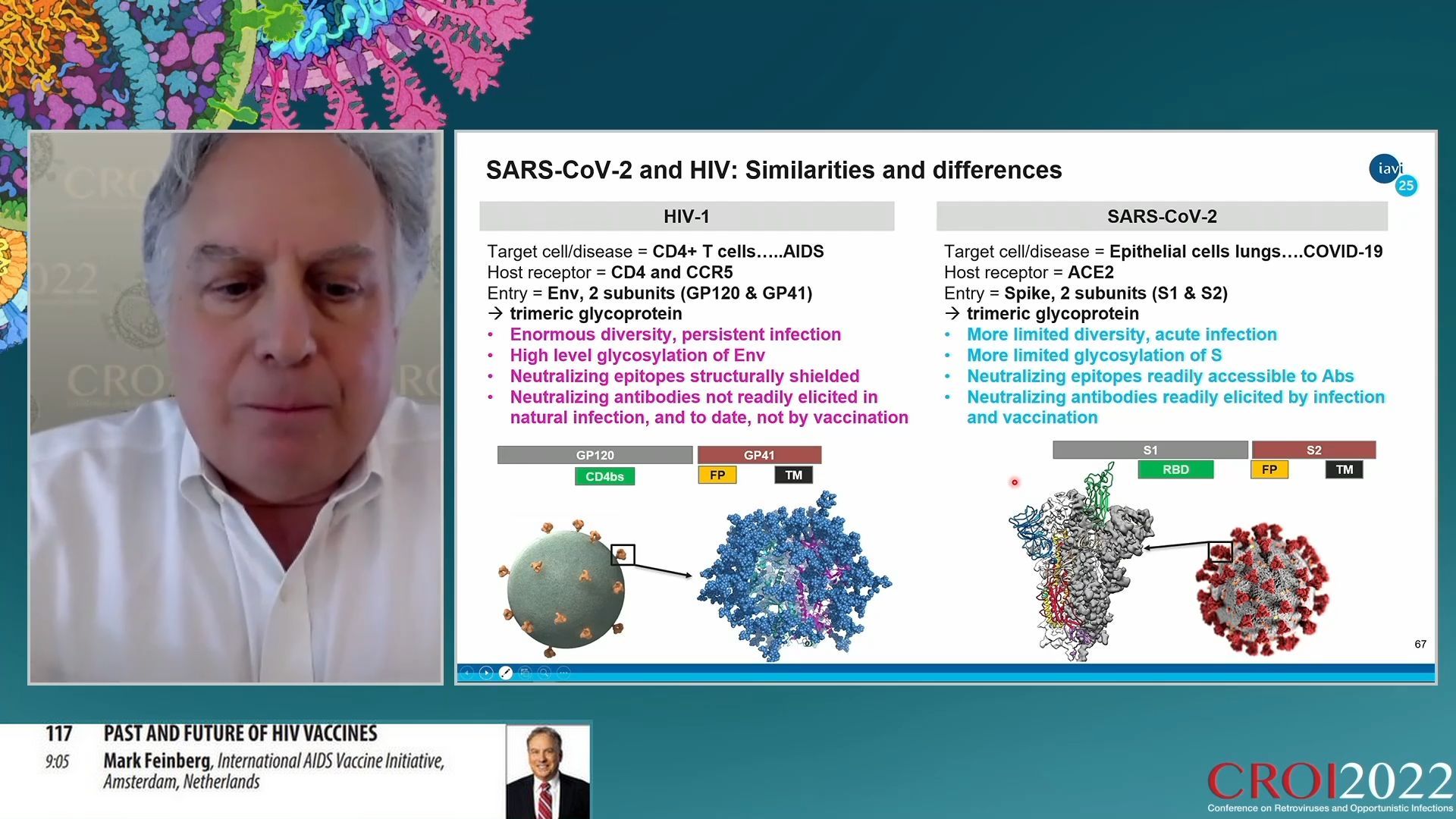
Quelles différences et similitudes entre VIH et SARS-CoV-2 ? Le VIH cible les lymphocytes T CD4 et cause une maladie, le sida ; il pénètre les cellules cibles avec une protéine de surface dite Env, tandis que le SARS-CoV-2 cible les cellules épithéliales des poumons, provoque une maladie appelée COVID-19 et pénètre dans les cellules cibles avec une protéine de surface appelée Spike. Le VIH a une diversité énorme et infecte son hôte de manière persistante. Le SARS-CoV-2 a une variabilité limitée et l’infection est aigue et temporaire. La protéine Env du VIH est fortement glycosylée, c’est-à-dire couverte de molécules sucrées qui rendent les sites de neutralisation peu accessibles par les anticorps, tandis que la protéine Spike du SARS-CoV-2 est faiblement glycosylée et peut aisément être neutralisée par les anticorps. Alors que les anticorps neutralisants sont très peu produits naturellement par le système immunitaire contre le VIH ils le sont rapidement et facilement contre le SARS-CoV-2. Et donc s’il n’existe pas de vaccin efficace contre le VIH à ce jour, il en existe de nombreux, très efficaces contre le SARS-CoV-2.
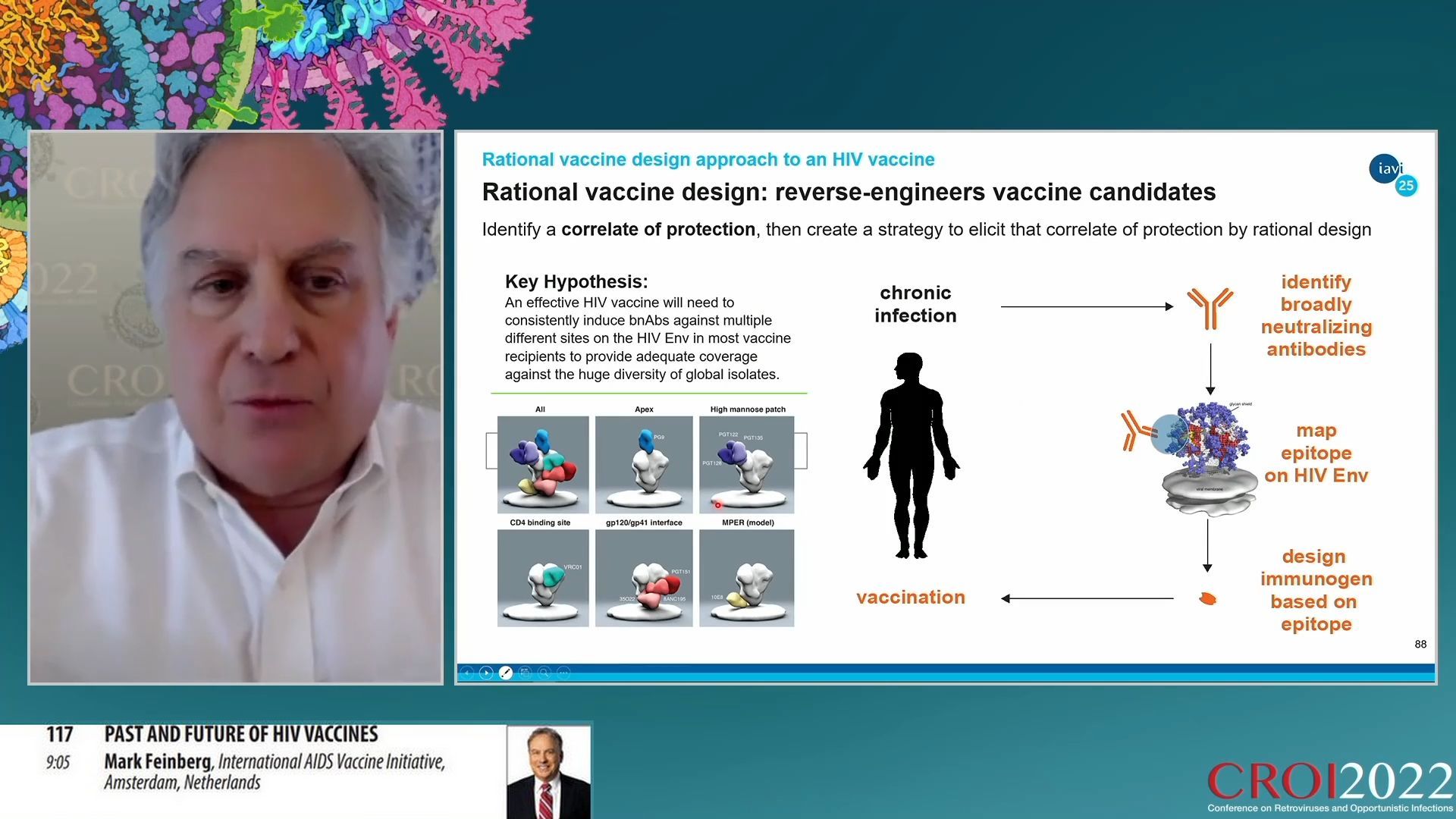
La méthode traditionnelle pour trouver un vaccin au début de l’histoire de l’infection à VIH était empirique. Elle consistait à sélectionner différentes molécules prometteuses et de les tester contre le virus. Lorsqu’une molécule semblait efficace, on essayait de déterminer les mécanismes de protection que cette molécule conférait. Comme rien n’a pu être obtenu par cette méthode, la recherche a opté pour une refonte de sa méthode. La méthode rationnelle consiste à déterminer quels mécanismes peuvent neutraliser le virus puis de construire une stratégie pour obtenir ce mécanisme par une conception rationnelle.
Ainsi, depuis 1981, six études d’efficacité de vaccins ont été conduites et elles ont toutes sauf une, conduit à des échecs. La seule exception est l’essai RV144 en Thaïlande qui a conduit à une faible efficacité. La reproduction récente de cette étude a conduit à un échec. Un essai de ce type est encore en cours à l’heure actuelle. Mais depuis peu la donne a changé. L’extraordinaire efficacité de la PrEP rend les études vaccinales bien plus difficiles à monter puisque, pour des raisons éthiques, il est impensable de de continuer à tester des vaccins chez des personnes potentiellement exposées sans leur offrir ce que l’on sait faire de mieux actuellement, la PrEP. Cela conduirait à des essais d’une taille et d’une durée infaisables. Aussi faut-il changer de méthode, en conduisant des recherches sur des marqueurs de protection induits que l’on peut mesurer dans les modèles pré-cliniques puis dans les premiers essais afin de mesurer l’efficacité potentielle d’un vaccin sans exposer les personnes.
Pour appliquer la méthode rationnelle au VIH, on a commencé par rechercher des anticorps neutralisants produits naturellement chez des personnes séropositives au VIH (IAVI protocole G). Dans un échantillon de 2000 donneurs, il a été possible d’en trouver chez 10% d’entre eux mais seulement 1% étaient des anticorps à fort pouvoir de neutralisation. Il a été montré que ces anticorps neutralisent bel et bien les sites sensibles et invariants de la protéine Env du VIH. De nombreuses études sur ces anticorps ont permis d’en étudier l’efficacité mais surtout les modes de sélection dans l’immunité naturelle. Leur processus de maturation est particulièrement long et, comparé aux anticorps neutralisants du SARS-CoV-2, on voit bien qu’ils ont nécessité un nombre de mutations de maturation dans les lymphocytes B bien supérieurs à ce qu’il faut pour produire les anticorps contre le SARS-CoV-2.
Des essais pour mesurer l’efficacité de protection de ces anticorps contre le VIH ont été montés. L’essai AMP de phase IIb mené sur près de 5000 personnes sur un an et demi permet de mesurer les titres d’anticorps nécessaires pour obtenir une neutralisation efficace. Ils sont conduits en utilisant VRC01, le premier anticorps fortement neutralisant, isolé en 2011 dans l’échantillon de volontaires de IAVI. On estime ainsi que la protection serait de 94% si l’on peut atteindre un titre de 1:300 par une vaccination produisant des anticorps contre au moins 3 sites de neutralisation.
Parmi les approches actuelles conduisant à fabriquer un vaccin capable d’induire des anticorps neutralisants, une piste particulièrement prometteuse est celle qui consiste à analyser à travers les anticorps que l’on connait quel a été le parcours de maturation progressive dans les cellules B qui a abouti au meilleur résultat. Cela a permis de comprendre que le parcours est effectivement long et il suggère qu’une vaccination progressive, favorisant par étapes successives la maturation de cellules B capables de produire ces anticorps pourrait réussir. Cette approche consiste donc à utiliser dans un premier temps un vaccin ciblant les cellules B naïves les plus appropriées. Ces cellules pourront alors dans un deuxième temps être renforcées par une deuxième vaccination appropriée pour sélectionner les cellules B mémoire appropriées. Puis une autre vaccination de renforcement peut affiner la maturation afin d’obtenir des anticorps neutralisants imitant ainsi par stimulations successives le long processus de maturation naturel qui existe chez les rares personnes porteuses de ces anticorps.
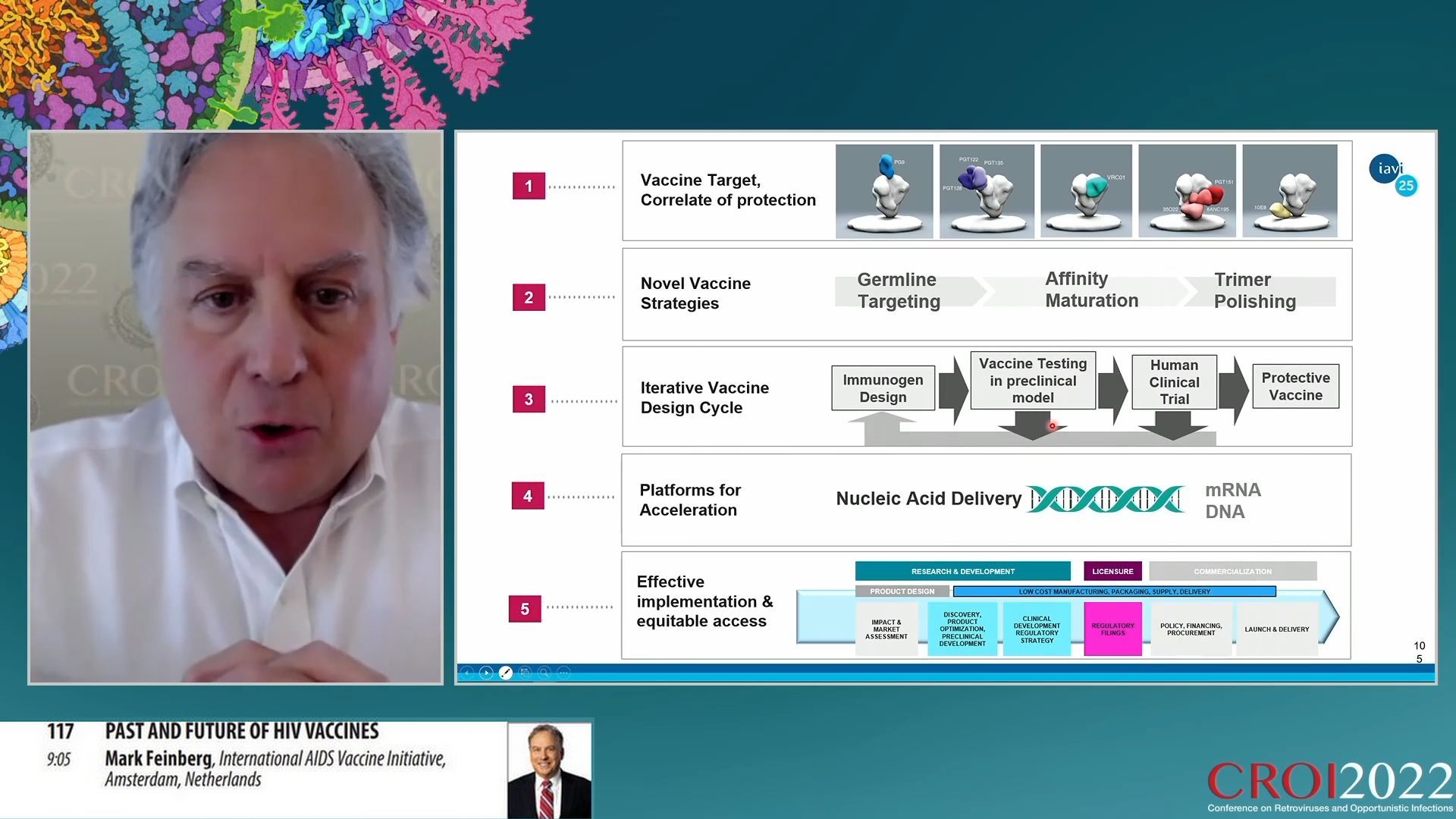
De nombreuses recherches et découvertes ont validé ce schéma, depuis la découverte du VRC01 en 2011 jusqu’à l’isolation de cellules B précurseurs de la classe VRC01 en 2018. Cela a permis la mise au point d’une protéine eOD-GT8 (engeenered Outer Domain Germline-Targeting version 8) sous forme d’une nanoparticule composée de 60 unités représentant le site de de liaison CD4 de la protéine Env. Puis l’organisation d’un essai clinique IAVI G001 de phase I pour tester cet immunogène. L’essai a donné d’excellents résultats démontrant qu’il était possible de sélectionner les cellules germinales appropriées précurseurs de la classe VRC01. La prochaine étape est donc la constitution d’un immunogène susceptible de renforcer ces cellules pour obtenir l’induction d’anticorps neutralisants d’une classe puis dans une autre étape, des anticorps neutralisants de plusieurs classes.
Une collaboration nouvelle avec le laboratoire Moderna a été initiée pour accélérer ce processus de recherche afin de mettre au point des vaccins à ARNm capables d’induire les réponses recherchées. C’est ainsi que sont lancés trois essais : IAVI G002 aux Etats Unis pour tester un ARNm capable de générer la protéine GT8 de sélection des lignées cellulaires appropriées, IAVI G003 pour le même test en Afrique et HVTN 302 qui testera un ARNm produisant une copie de la protéine naturelle. Ces essais permettront de voir quelle plate-forme est la plus efficace à produire une réponse appropriée attendue.
Les défis d’aujourd’hui ne sont plus tant de connaissance mais de technologie afin de trouver des solutions pour gagner du temps et arriver à des résultats qui font progresser vers la solution tant recherchée.
CROI 2022 – la suite…
Dans la suite de nos compte-rendus de la conférence, découvrez « Vieillir avec le VIH » et « Les nouveaux antirétroviraux et l’avenir des traitements et de la prévention » en allant à :
CROI 2022 – Deuxième partie
