Andrew Phillips et ses collègues ont réalisé une modélisation de la transmission du VIH dans la communauté gay afin d’étudier les conditions à mettre en œuvre pour réduire l’incidence du VIH au Royaume Uni. La proximité des données françaises permet de s’y intéresser de près et même si certains choix ont été différents en France, le cœur de cette modélisation a encore beaucoup à nous apprendre sur les facteurs clés du contrôle de l’épidémie.
Le possible impact sur l’incidence d’une augmentation de la fréquence de dépistage du VIH et de la mise sous traitement précoce chez les HSH
Par Andrew N. Phillips, Valentina Cambiano, Alec Miners, Fiona C. Lampe, Alison Rodger, Fumiyo Nakagawa, Alison Brown, O. Noel Gill, Daniela De Angelis, Jonathan Elford, Graham Hart, Anne M. Johnson, Jens D. Lundgren, Simon Collins and Valerie Delpech – Publié en juin 2015
Le VIH touche majoritairement les hommes ayant des rapports sexuels avec d’autres hommes (HSH) un peu partout au monde. Malgré un intérêt croissant pour le contrôle de l’épidémie grâce à la mise sous traitement de tous les séropositifs et sa mise en œuvre dans de nombreux pays occidentaux comme le Royaume Uni, l’incidence du VIH dans la population gay ne baisse pas, au point que son efficacité populationnelle laisse des doutes.
Les facteurs d’influence du traitement antirétroviral sur l’incidence sont variés. Premièrement, à combien le taux de transmission d’une personne à son partenaire négatif est-il réduit par le traitement antirétroviral ? Jusqu’à récemment il n’y avait pratiquement aucune preuve directe de ce que représente le risque de transmission au cours du sexe anal. Mais les résultats intermédiaires de l’étude PARTNER (voir notre article) situent ce risque à zéro même en présence d’autres infections sexuellement transmissibles avec un intervalle de confiance assez large. Deuxièmement, il est important d’évaluer la tendance générale au sexe sans préservatif et plus particulièrement, de savoir dans quelle mesure le succès thérapeutique des traitements antirétroviraux peut induire une progression du sexe sans préservatif entraîné par une moindre peur du VIH. Le fait qu’une forte proportion des nouvelles infections sont causées par des personnes infectées qui ne le savent pas ou encore par celles qui viennent juste de s’infecter est une troisième considération. Tout cela constitue des limites au potentiel du traitement antirétroviral à réduire les nouvelles infections chez les gays. Ce qu’il faut évaluer, c’est à quelle fréquence le dépistage est répété et à quelle vitesse les personnes diagnostiquées entrent dans le soin et sont mises sous traitement antirétroviral. Et puis il faut prendre en compte le seuil auquel initier un traitement a un bénéfice individuel pour les personnes. Ce seuil était incertain pendant longtemps et les recommandations ont beaucoup varié. Au Royaume Uni, le seuil a longtemps été fixé à 350 lymphocytes T CD4+/µl, plus bas que de nombreuses autres recommandations. Ce n’est que récemment que le Strategic Timing of Antiretroviral Treatment (http://insight.ccbr.umn.edu/start/) et le résultat de l’essai Temprano ont recommandé une initiation précoce du traitement antirétroviral comme étant bénéfique pour la santé même chez des personnes avec plus de 500 lymphocyte T CD4+/µl. D’autant plus que cet effet se cumule avec celui du traitement comme prévention (TasP) défini selon l’intérêt collectif d’offrir un traitement à toute personne séropositive afin de réduire son risque de transmission du VIH. Ensuite, il faut prendre en compte non seulement la mise sous traitement mais aussi le niveau d’observance et le contrôle viral ainsi que le développement de résistances, la possibilité de transmission de résistances et son potentiel à réduire l’efficacité du traitement antirétroviral.
Une modélisation tenant compte de tous ces facteurs avec une analyse coût-efficacité est utile pour aider à la décision des règles de réduction de l’incidence du VIH. Cet article présente une telle étude basée sur le contexte du Royaume Uni et présentant ce qui serait nécessaire en terme de fréquence de tests, d’initiation et de couverture de traitement pour obtenir une réduction de l’incidence actuelle d’environ 6 pour 1000 personne-année à moins de 1 pour 1000 chez les HSH (535 nouvelles infections dans la population adulte HSH séronégative d’environ 535 000 individus), ce qui revient à un niveau équivalent à celui de la population hétérosexuelle. Cette étude évalue aussi l’investissement nécessaire pour atteindre un résultat justifié pour le système de santé britannique.
Méthode
-
Simulation du VIH dans la population HSH au Royaume Uni
Nous utilisons un modèle de simulation dynamique au niveau individuel afin de recréer le risque VIH au cours de la vie et pour ceux qui sont infectés par le VIH, les observations sur la progression du VIH et les traitements de la population HSH du Royaume Uni depuis 1980. Le modèle et sa calibration ont été décrits précédemment et sont mis à jour avec les observations faites jusqu’en 2012. En bref, nous prenons en compte l’âge, le sexe sans préservatif avec un partenaire primaire (à long terme) et à court terme (occasionnel), la présence d’autres IST, les habitudes de dépistage du VIH, et chez ceux qui vivent avec le VIH, la charge virale, le compte de CD4+, l’utilisation spécifique d’antirétroviraux, l’adhésion au traitement, la présence de résistances, le risque de sida et de mortalité, incluant le risque de mortalité non due au sida. Nous nous basons sur une population fermée, considérant que les migrations entrantes et sortantes se compensent. Les paramètres déterminant le comportement sexuel, le taux de transmission, les habitudes de dépistage et la possibilité que le diagnostic de VIH puisse réduire l’usage du préservatif, varient à chaque exécution de la simulation avec un échantillonnage distribué. Les résultats obtenus sont comparée aux données sources – en tout, nous avons exécuté le modèle plus de 100 000 fois avec 101 ensembles de paramètres susceptibles de reproduire l’épidémie telle qu’on l’observe. Ces 101 ensembles de paramètres produisant un résultat proche de ce que l’on observe actuellement ont été utilisés pour réaliser les projections d’avenir.
-
Les scénarios d’avenir et les analyses économiques
Ayant réussi à reproduire l’épidémie actuelle, nous avons réalisé les projections dans le futur de 2015 à 2030. Cela fut fait en commençant par ne rien changer des habitudes de dépistage et des critères de mise sous traitement. Les principaux résultats pris en compte sont (pour les HSH âgés de 15 à 65 ans) la proportion de HSH avec le VIH ayant une charge virale contrôlée (<500 copies/ml) le nombre de cas incidents de VIH par an, la prévalence du VIH, le nombre d’hommes sous traitement, le total des années de vie ajusté sur la qualité de vie (QALYs) et le coût des soins (les deux avec une régression de 3,5% par an). Nous avons ensuite évalué le résultat de situations dans lesquelles, à partir de 2015, la récurrence de dépistage était augmentée (de valeurs prédéterminées appelée « Test rate + » et « Test rate ++ » correspondant à une progression partant la valeur actuelle où 19% de tous les HSH sont testés au cours d’une année à 38% puis 65%, avec un dépistage fortement dépendant de l’existence d’un rapport sexuel récent sans préservatif). Ensuite nous avons changé les règles de mise sous traitement pour un traitement immédiat après le diagnostic.
Nous avons initialement fait cela en partant de l’hypothèse qu’aucun changement de fréquence de sexe sans préservatif ou de niveau d’entrée et de maintien dans le soin et d’observance du traitement n’aurait lieu. Puis nous avons évalué les effets d’une augmentation du sexe sans préservatif puis d’une réduction du lien vers le soin et de l’observance du traitement. Les coûts et le changement de QALYs comparés avec le scénario actuel ont été meurés pour les autres scénarios pour les valeurs de rapport coût-efficacité acceptables. Nous avons d’abord tenu compte d’un prix stable au niveau actuel des prix puis de prix remisés et incluant l’usage de génériques (avec une baisse de prix linéaire du prix actuel en 2015 jusqu’à 30% à 80% sous le prix actuel). Notre analyse se place dans la perspective du système de santé britanique.
Résultats
Les résultats de la simulation concordent généralement bien avec les données actuelles jusqu’en 2012. En 2015, au moment de changement de scénario considéré, le nombre de HSH vivant avec le VIH est estimé à 53 500 (soit environ 3500 nouvelles infections en 2015, une incidence de 6 pour 1000 personne-année) dont 40 200 (75%) sont diagnostiqués et 33 200 (62%) sont sous traitement (pour 34 700 ayant initié un traitement, ce qui représente un niveau élevé de rétention dans le soin). Parmi ceux qui sont sous traitement, 92% ont une charge virale à moins de 500 copies/ml. En général, on estime que 58% des HSH vivant avec le VIH au Royaume Uni sont sous traitement avec une charge virale à moins de 500 copies/ml.
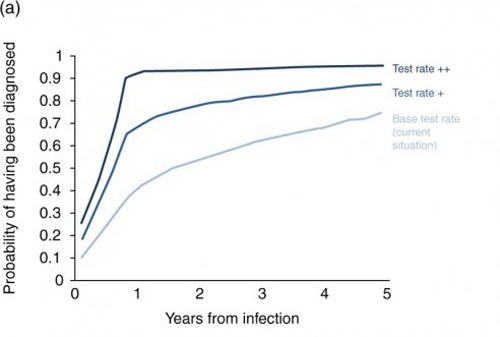
Figure 1a
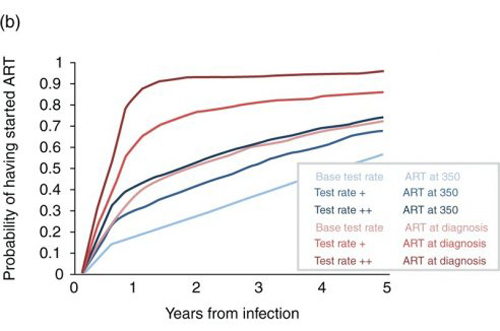
Figure 1b
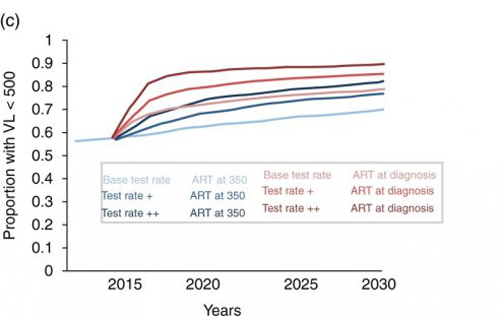
Figure 1c
L’augmentation potentielle du dépistage considérée après 2015 est illustrée en figure 1a. Les Test Rate + et Test Rate ++ représentent une augmentation de 110 000 tests par an à 215 000 et 370 000 tests par an. Actuellement, environ 36% des hommes sont diagnostiqués dans l’année et 70% dans les 5 ans qui suivent l’infection. Avec le scénario de Test rate + ces pourcentages deviennent 65% et 85% respectivement et avec le Test rate ++, 90% et 93%. La figure 1b indique les pourcentages de HSH qui initient un traitement antirétroviral au moment du diagnostic en plus de la stratégie actuelle, commencer avec des lymphocytes T CD4+ à moins de 350/µl. Actuellement, moins de 20% des hommes initient un traitement dans l’année qui suit leur infection tandis qu’avec le Test rate ++ et le scénario de traitement au diagnostic, ce serait 90%. La figure 1c montre la proportion prévisible de HSH séropositifs avec une charge virale en dessous de 500 copies/ml dans l’année en fonction de la fréquence de dépistage et du scénario de mise sous traitement. Une augmentation de la fréquence de dépistage au Test rate ++, même sans changement de la stratégie de mise sous traitement, correspond à une augmentation de 60% à 80% de cette proportion en 2030. Si le traitement est initié au moment du diagnostic, ce pourcentage passe à près de 90%.
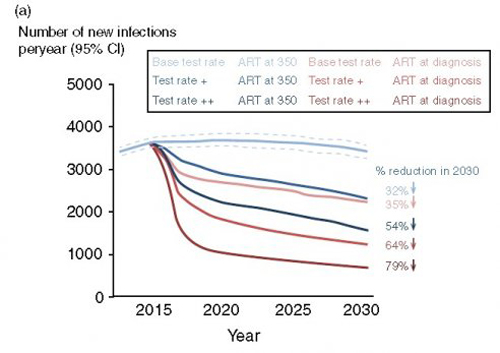
Figure 2a
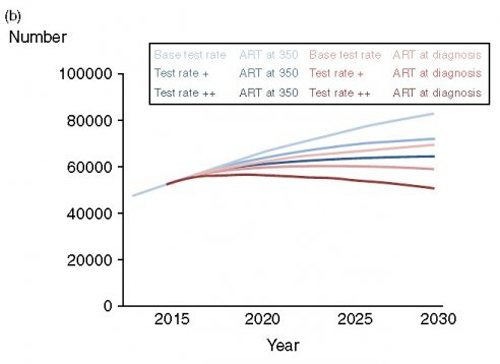
Figure 2b
L’impact prévisible des scénarios alternatifs sur l’incidence du VIH est représenté dans la figure 2. On observe une remarquable réduction de l’incidence associée à l’augmentation du dépistage même en l’absence de changement de stratégie de mise sous traitement, une baisse de 54% avec le Test rate ++ en 2030, qui atteint 2,5 pour 1000 personne-année. Cependant en combinant ces augmentations, de fréquence de dépistage et de mise sous traitement au diagnostic on obtient des changements très significatifs – une réduction de 79% en 2030, à 675 nouvelles infections par an (1,2 pour 1000 personne-année). Ce dernier scénario est le seul dans lequel le nombre d’hommes vivant avec le VIH est inférieur en 2030 à ce qu’il est en 2015 (50 000 comparé à 82 000 en poursuivant le scénario actuel) ce qui représente une situation où il y a 0,014 nouvelle infection par an pour chaque personne vivant avec le VIH – bien inférieure à 1 infection dans la durée de la vie sexuelle. Le nombre d’hommes sous traitement augmente rapidement avec le scénario Test rate ++/traitement au diagnostic mais il atteint un plateau au bout de 5 ans puis commence à décroître. C’est le scénario dans lequel il y a le moins d’hommes sous traitement en 2030.
Les niveaux de rétention dans le soin et d’observance sont actuellement très élevés au Royaume Uni mais pour comprendre l’importance que ça a, il faut évaluer ce que ce serait si c’était réduit. La figure 5 suppl montre l’effet d’une réduction de l’observance et de la rétention dans le soin d’environ 10% sur la proportion des HSH vivant avec le VIH qui ont une charge virale contrôlée en 2020, de 63% s’il n’y a pas de changement à 53%. On prédit que cela conduirait à 1000 nouvelles infections supplémentaires par an en 2030. C’est aussi le cas si la stratégie de dépistage/mise sous traitement actuelle est maintenue ainsi que pour la stratégie Test rate ++/mise sous traitement au diagnostic.
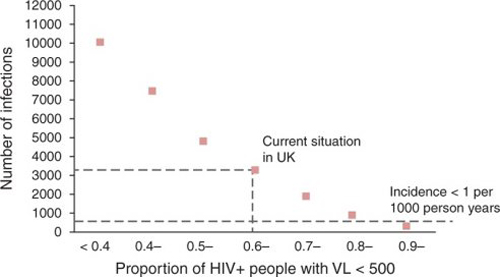
Figure 3
Au-delà d’une série de simulations avec des scénarios comprenant différentes fréquences de dépistage, différents critères d’initiation de traitement (y compris des scénarios avec un critère d’initiation de traitement en dessous de 500 lymphocytes T CD4+) et avec le niveau d’observance/rétention dans le soin ou le faible niveau décrit précédemment, il est possible de décrire le nombre de nouvelles infections par an que l’on peut espérer pour un nombre de HSH vivant avec le VIH donné (diagnostiqué ou non) avec une charge virale contrôlée (Fig. 3). Dans cette figure la situation actuelle au Royaume Uni est indiquée – près de 60% de HSH infectés ayant une charge virale contrôlée sous traitement antirétroviral avec un peu plus de 3000 nouvelles contaminations par an. La relation est à peu près linéaire sur une échelle logarithmique – chaque tranche de 10% de plus de HSH avec le VIH en contrôle virologique est associée avec environ 37% de nouvelles infections par an en moins. Ce tracé suggère qu’il faudrait augmenter la proportion d’hommes en contrôle virologique de 60% à 90% pour atteindre une incidence en dessous de 1 pour 1000 personne-année.
Jusque-là nous avons considéré que le niveau de rapports sans préservatif restait à sa valeur actuelle, tel que la proportion d’hommes ayant des rapports sexuels anaux sans préservatif soit comme celle de l’année dernière de 62% jusqu’en 2030, au lieu des 52% actuels. Cela a été modélisé comme étant une progression générale, non discriminante, de sexe sans préservatif, n’impliquant pas plus spécialement ceux sous traitement ou ceux dont la charge virale est contrôlée, ce qui est différent d’une augmentation du sexe sans préservatif chez les séropositifs diagnostiqués qui sélectionnent leurs partenaires parmi les hommes qui sont diagnostiqués.
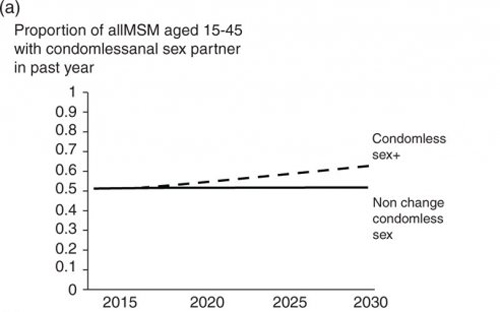
Figure 4a
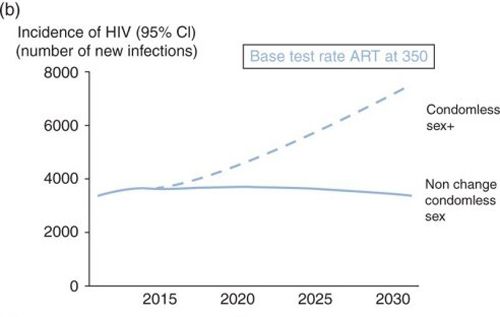
Figure 4b
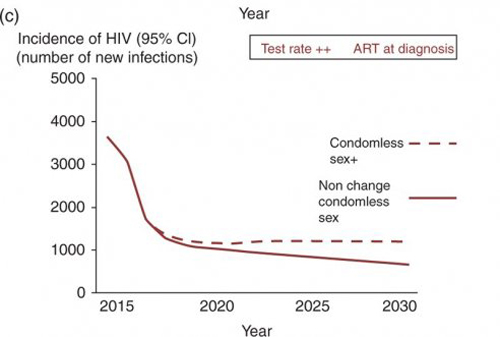
Figure 4c
L’impact sur l’incidence du VIH de l’augmentation du sexe sans préservatif est très importante dans un contexte où la fréquence du dépistage et la stratégie d’initiation du traitement ne change pas (un doublement de l’incidence du VIH en 2030 ; fig.4b) et bien moindre dans le cas du Test Rate ++ et du scénario d’initiation du traitement au diagnostic Fig.4c. Dans la fig. 5 suppl, on représente l’association de différents scénarios faisant varier le nombre de rapports sans préservatifs en 3 mois et la charge virale sous les 500 copies/ml et l’incidence du VIH. Actuellement on estime qu’il y a environ 10 000 rapports de ce genre en 3 mois. Ce nombre est fortement lié à l’incidence du VIH et il faut le réduire de 2000 pour voir baisser l’incidence à moins de 1/1000 par an. La réduction du sexe sans préservatif et l’augmentation de la proportion de HSH avec le VIH sous traitement et avec une charge virale à moins de 500 copies/ml sont les clés significatives qui permettent de réduire le nombre de rapports sans préservatifs lorsque la charge virale est à plus de 500 copies/ml.
En général, le nombre d’années de vie en bonne santé (QALYs) des HSH âgés de 15 à 65 ans (aussi bien séropositifs que séronégatifs) entre 2015 et 2030, en tenant compte des réductions, est évalué à 6 393 500, en poursuivant le rythme actuel de dépistage et la stratégie de mise sous traitement. Le coût total tenant compte de la réduction des soins du VIH durant cette période est de 5,5 milliards £ comprenant environ 4,7 milliards £ en coût de traitement en se basant sur les prix actuels des antirétroviraux. La Fig. 7 suppl illustre les différences de QALYs selon les scénarios de dépistage et d’initiation de traitement. Le bénéfice d’une augmentation du dépistage augmente avec le temps. Le scénario qui présente le plus de QALYs est le scénario Test rate ++/ traitement au diagnostic.
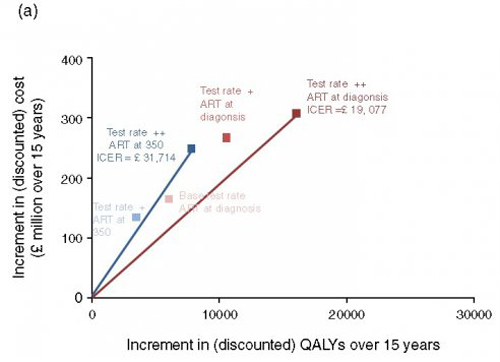
Figure 5a
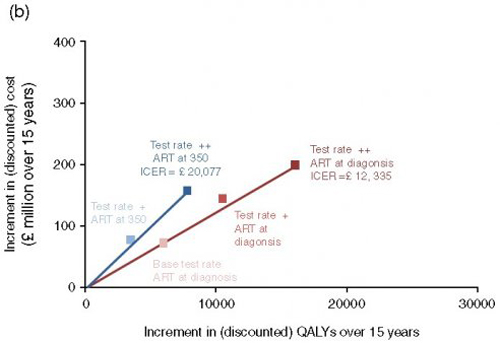
Figure 5b
La fig. 5 représente les résultats de coût-efficacité. Tenant compte de la liste actuelle de prix des antirétroviraux (fig. 5a) et avec l’initiation du traitement au diagnostic, la politique la plus coût-efficace (ICER le plus bas) est le scénario Test rate ++/traitement au diagnostic avec un ICER à 19 077 £ par QALY gagnée au-delà de notre base de 15 ans. En tenant compte des réductions de prix et des génériques, l’ICER est significativement plus bas à 12 335 £. La Fig 11 suppl représente la courbe d’acceptabilité de coût-efficacité pour le scénario Test rate ++/traitement au diagnostic. Cette hypothèse n’inclut pas de coût additionnel pour une augmentation du dépistage au-delà de celle comptabilisée à 20£ par test réalisé. 8 millions de £ supplémentaires par an pour l’implémentation de la politique d’extension du dépistage augmenterait le coût incrémental total sur 15 ans à 319 millions £ mais conserve le ICER en dessous de 20 000 £. Dans une analyse plus fine dans laquelle on considère la réduction du prix des médicaments entre 2015 et 2030, de 50% au lieu de 80% du prix actuel, le ICER est de 12 428£.
Toujours sur la Fig.5, lorsque l’on restreint les changements de scénarios à la seule augmentation du dépistage, en prenant la liste de prix actuels des antirétroviraux, le ICER tenant compte de l’augmentation du dépistage est autour de 30 000£ pour les 15 prochaines années bien que le ICER tend à décroître sur un temps long en raison du bénéfice de l’augmentation de QALY et du nombre de personnes sous traitement plus faible, comparé à la fréquence de dépistage actuelle. Avec les prix réduits et les génériques des médicaments, le ICER pour le scénario Test rate ++ est de 20 077£ ce qui suggère que le dépistage est coût-efficace même sur une durée de 15 ans.
Discussion
Nous avons montré qu’au Royaume Uni, un dépistage plus fréquent et un traitement plus précoce permettant d’obtenir une incidence inférieure à 1 pour 1000 personne-année, requiert de passer de 60% à 90% la proportion de HSH avec le VIH ayant une charge virale contrôlée.
Cela implique que 90% des hommes soient diagnostiqués dans l’année de leur infection et qu’il n’y ait pas d’augmentation des relations sexuelles sans préservatifs. Compte tenu de la forte espérance de vie des personnes vivant avec le VIH, cette réduction de l’incidence est nécessaire pour observer une décroissance du nombre de HSH vivant avec le VIH. Nous avons déterminé les conditions de dépenses en dessous desquelles l’augmentation du dépistage est coût-efficace. Tenant compte des baisses de prix des médicaments et de l’utilisation de génériques, les règles d’augmentation du dépistage sont coût-efficaces (en se basant sur un seuil de 20 000 £ par QALY) du point de vue du NHS britanique, s’il est possible de le réaliser pour moins de 8 millions £ par an. L’initiation du traitement au diagnostic est aussi coût-efficace.
Réussir à atteindre un tel niveau de suppression virale revient à réaliser un changement culturel dans la manière d’organiser le dépistage de telle sorte que 90% des hommes avec le VIH soient diagnostiqués dans l’année qui suit leur infection de même que leur mise sous traitement au diagnostic. Proposer aux patients la mise sous traitement immédiate est approprié au vu des résultats récents des essais qui montrent un bénéfice en termes de santé individuelle du traitement précoce, et de plus, on sait qu’un certain nombre d’hommes souhaitent initier un traitement antirétroviral afin de réduire leur infectivité, même en l’absence de bénéfice pour leur santé. L’augmentation du dépistage, même sans changement des règles de mise sous traitement, peut avoir un impact certain sur l’incidence. Cette nécessaire augmentation du dépistage requiert une campagne ambitieuse, dirigée et générée par la communauté, conçue pour atteindre les groupes les plus à risque dans la communauté gay. Les initiatives devraient inclure largement le recours aux auto-prélèvements et aux autotests, une forte promotion du dépistage, un accès simplifié au dépistage pour les HSH dans les cliniques utilisant des procédures de rappel par messagerie mobile et une promotion pour une meilleure connaissance des symptômes de la primo-infection du VIH. Il a été montré que les campagnes de publicité en ligne augmentent directement les demandes de kits d’auto-prélèvements gratuits.
Notre modèle prédit que l’incidence du VIH pourrait être grandement réduite avec une augmentation consistante du dépistage du VIH même si pour beaucoup d’hommes il ne soit pas réellement réalisable de diagnostiquer le VIH au cours de la primo-infection et d’initier un traitement, ce qui constitue un obstacle majeur à l’utilisation d’antirétroviraux pour prévenir la transmission. C’est sans doute parce que de nombreuses chaines de transmission contiennent des liens résultant de la transmission par des personnes infectées depuis des années – ces liens peuvent être rompus par un programme de haut niveau de dépistage et une mise sous traitement immédiate, réduisant ainsi la fréquence de l’impact des primo-infections.
Bien des modélisations de l’effet de l’augmentation du dépistage et/ou des traitements sur l’épidémie de VIH chez les HSH ont déjà été réalisées ainsi que des analyses de coût efficacité. En général les modèles soutiennent fortement l’augmentation du dépistage chez les HSH. Notre analyse s’ajoute à cette littérature par une modélisation à un niveau plus important de détails et de variables individuelles pour la calibration desquelles de nombreuses sources de données sont disponibles (la charge virale, l’utilisation de médicaments spécifiques, l’acquisition et la transmission de résistances spécifiques aux médicaments, le compte de lymphocytes T CD4+), augmentant la confiance que les résultats du modèle représentent bien ce qui se passerait pas la vraie vie dans le contexte britannique. De plus nous indiquons les cibles précises de fréquence de dépistage et la proportion d’hommes en contrôle viral qu’il faut atteindre.
Il est à noter qu’il y a une certaine variabilité de l’incidence du VIH entre les différentes exécutions du modèle (les principaux effets ont été décrits) qui reflète bien la nature stochastique des émergences de primo-infections ainsi que les effets de réseau dans lesquels existent parfois des hommes qui ont un haut niveau de sexe sans préservatif sans être sous traitement. Une autre limite à prendre en compte est que ce modèle prend en compte une population fermée, ce qui n’est en fait pas le cas. Les HSH qui viennent d’ailleurs et ont des relations sexuelles au Royaume Uni n’ont pas forcément le même bon niveau d’accès aux traitements que les résidents du Royaume Uni. Il est donc important que le dépistage chez les gays ait un niveau élevé et que les traitements soient accessibles partout au monde. Nous avons tenu compte d’une utilisation future de médicaments génériques en estimant que leur efficacité en termes de contrôle viral serait équivalente aux médicaments originaux, mais considérant aussi que la difficulté accrue des patients à être observant avec des combinaisons non fixes peut être améliorée en les changeant de traitement pour des combinaisons en un seul comprimé alors que les combinaisons fixes en un seul comprimé générique ne serait pas disponibles avant longtemps. Walensky et al. avait montré dans un modèle précédent une faible réduction du contrôle viral avec des médicaments génériques mais les avait montré comme étant très coût-efficaces.
En conclusion, nous avons montré qu’un investissement substantiel dans l’augmentation du dépistage du VIH chez les HSH peut être une solution coût-efficace pour réduire l’incidence du VIH de même que l’initiation du traitement au diagnostic. Cependant il est essentiel que le niveau de sexe sans préservatif n’augmente pas et que la rétention dans le soin et l’observance restent à un niveau élevé.
